|
Les
Herpesviridae
|
Vient du grec « herpein » qui signifie accroché de façon permanente.
En 1950, Burnet et Buddingh montrèrent que le HSV (Herpes Simplex Virus) pouvait devenir latent après une primo infection. Sa réactivation (et non une surinfection) peut être causée par une 2nde infection. Weller (1954) isola le VZV (Varicella Zoster Virus) d’un zona (bouton de varicelle), l’agent causal était le même.
Environ 100 espèces d’Herpesvirus ont été isolés, au moins un pour chaque espèce animal testée. Huit virus humains connus (un 9ème serait en cours). La famille est divisée en 3 groupes :
û a Herpesvirinae : Simplexvirus (HSV1 ; HSV2)
Varicellovirus (VZV) (HHV3)
û b Herpesvirinae : Cytomegalovirus (CMV) (HHV5)
Muromegalovirus (Mouse Cytomegalovirus)
Roseolovirus (Human HerpesVirus 6 et 7 (HHV6 et HHV7)
û g Herpesvirinae : Lymphocryptovirus (Epstein Barr Virus (EBV)) (HHV4)
Rhadinovirus (HHV8)
Ces virus possèdent des spécificités cellulaires, ce qui gouverne le mode d’infection.
Ce sont des virus à très gros génome (350 kpb soit 35 fois celui du HIV) qui code donc pour un très grand nombre de protéines, il emporte beaucoup de fonctions qui lui sont propres (kinases…). Leur réplication ainsi que leur assemblage sont nucléaires.
1. Structure
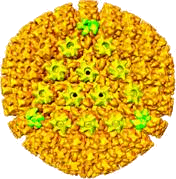
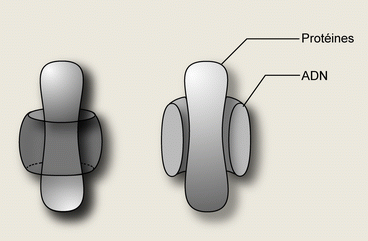
La taille des virus varie de 180nm à 250-280nm. Il possède une enveloppe composée de glycoprotéines. Entre l’enveloppe et la capside se trouve un tégument qui permet le maintien des structures. La capside est icosaédrique de 95-120nm et composée de 162 hexons et 12 pentons.
 |
|
En vert les pentons En jaune les hexons (Remarquez ici une face qui a été colorée volontairement). |
Le core consiste en une structure torique d’ADN double brin linéaire s’enroulant autour de protéines.
2. Génome
Tous les génomes d’Herpesvirus ont une région unique longue (UL) et une courte (US) liées par des répétitions inversées (IR). Les IR permettent le réarrangement des régions uniques, les génomes d’Herpesvirus existent comme des mélanges de 4 isomères. Ils contiennent aussi plusieurs séquences répétées. La taille des génomes de particules virales isolées peut ainsi varier jusqu’à 10kbp. Le pourcentage de GC varie de 32 à 75% amenant ainsi une certaine stabilité de la double hélice. (Plus il y a de GC et plus il y a de dégénérescence du code, ce qui augmente la flexibilité d’adaptation).
|
Deux génomes d’Herpesvirus sont hétérologues alors que les protéines synthétisées sont identiques. Les gènes codant pour des protéines essentielles sont des gènes codant pour des protéines associées en bloc (comme des opérons). L’homologie de génome au sein d’un patient est d’environ 80-90%. Pendant une épidémie (passant d’un patient A vers un B), le taux d’homologie descend jusque 25%, le milieu aura sélectionné la souche la plus propice à sa multiplication dans le sujet B.
Dans les parties L et S, environ 200 ORF numérotées (50 ORFs dans S). TRL contient 14 ORFs, UL en contient 133, US en contient 36 et TRS n’en a qu’un seul. On retrouve des gènes qui codent pour des protéines non essentielles dans la réplication (glycoprotéines…). Trois promoteurs sont possibles pour l’expression du génome, ils pourraient être utilisés pour former un même transcrit. Un promoteur peut permettre la production de 7 à 8 protéines différentes. |
3. Réplication
La cible cellulaire peut être variable (sauf les gHV pour les lymphocytes B). Le CMV (gHV) a un tropisme spécifique. La pénétration se fait par l’intermédiaire d’un ou plusieurs récepteurs qui, pour le CMV, est composé de protéine de 3kD et d’une phosphoglycoprotéine d’environ 92-93kD. Il y a fusion membranaire entre la glycoprotéine d’enveloppe et la protéine de la membrane. Dés absorption, il y a relargage de la capside dans la cellule. In vitro,la rapidité est telle qu’au bout de 30 secondes, on peut avoir absorption et pénétration. Au bout d’une minute, on a fusion des vacuoles avec les membranes nucléaires ce qui permet une activation immédiate des signaux cellulaires.
Au moment de leur relargage, ils pourraient apporter des protéines cellulaires (qui seraient activateurs) qui mettraient rapidement en route les CMV. Quelques protéines de capside et téguments sont retrouvées dans le noyau, la protéolyse n’est pas assez rapide. Son expression est lente par contre. Au moment du bourgeonnement, beaucoup de production vont jusqu’au cycle lytique.
L’enveloppe contient 9 protéines d’enveloppe. En ôter une n’affectera pas le niveau d’inféctivité. Si on enlève plusieurs glycoprotéines, la fusion devient minoritaire et c’est l’endocytose qui primera. Les ARN sont classés en 3 catégories :
- IE : Immediate Early (transrégulateurs de la transcription virale).
- E : Early (quelques protéines de régulation et un peu de structurales).
- L : Late (protéines majeures de structure).
En bloquant la transcription, les messagers IE s’accumulent dans le noyau, les E et L ne seront pas synthétisés. Dés que l’on passe à l’expression des E, on a extinction des IE. Dans ces gènes E, il y a présence des gènes de mise en route de la réplication du génome. Certain gènes mis en jeu dans l’expression des L sont synthétisé après la réplication. Certains sont produits indépendamment de la réplication.
Les gènes γ1 et γ2 sont produits indépendamment. La réplication du génome nécessite IE et E. Pour cette réplication, il y a une DNA pol virale et des DBP virales.
Il y a utilisation d’enzymes cellulaires (thymidine kinase…), de protéines cellulaires pour la réplication. Trois étapes composent la régulation : Etablissement de la latence, Maintenance de la latence et réactivation de la latence.
LA latence intervient chez les HSV au niveau des neurones sensoriels qui innervent le lieu de la primo-infection au SNC.
Le virus doit survivre sans être repéré, ni détruire la cellule. On a donc transcription que d’une partie du génome. Ce sont les gènes qui flanquent les 2 grandes séquences répétées (TRL et IRL) qui sont impliquées dans cette latence. C’est un promoteur unique qui permet l’expression de ces gènes (= transrégulation). On a toute une famille de transcrits nucléaires appelés transcrits associés à la latence (LAT= Latency Associated Transcript). Deux majeurs de 1,5kb et 2kb qui sont dépourvus de queue poly-A (bloqués dans le noyau).
Par rapport à un gène IE, ils correspondent à une structure antisens d’une gène IE appelé ICPO (interviendrait dans la réactivation). En ôtant les LAT, on a un blocage partiel.
Le CMV possède un promoteur fort modulable pour la pol III. Après les Late, il y a les DL (Delayed Late= tardifs retardés).
3.1. Les gènes IE
Composés de 2 régions : région US3 et UL 36-38
La majeure partie de la transcription se passe dans la région 122-123 (divisée en IE1, 2…) c’est une zone très active au niveau transcriptionnelle. Beaucoup d’études ont été menées à ce sujet, il a été montré notamment que cette zone commençait par donner un RNA basal de 5kb environ qui ne coderait pour aucune protéine. Ce sont les différents réarrangements qui permettent le codage. IE1 et 2 sont régulés par un promoteur très fort. Il comporte un certain nombre de séquence de régulation. Ce promoteur est très proche de celui des Lentivirus (composé comme SP1).
En dehors de ces zones régulatrices, beaucoup d’autres d’effets interviennent (fixation de la p53…).
Elle va réguler négativement l’expression du promoteur (cf. adénovirus).
Un facteur cellulaire, MBF1, intervient aussi.
NF KB et SP1 sont trouvés dans de nombreux virus (oncornavirus, lentivirus…) mais aussi ici. Ce sont les protéines tat des lentivirus et tax des oncornavirus qui interagissent et activent les virus de l’herpes (transactivation croisée).
La région 1-2 va donner des messagers (8 messagers) qui vont résulter de l’épissage. Le taux de transcription varie pendant le cycle viral. Les gènes précoces sont arrangés de même façon (1,2 et 3 sont conservés), 6, 7 et 8 ont les même CT.
Dans la région 2, il y a variation de composition.
Le virus doit limiter sa production de messagers et les réarranger. Il peut ainsi produire 8 messagers différents à partir d’une seule séquence.
Ils sont souvent associés (ces transcrits) à des polysomes (dés qu’ils quittent le noyau). Entre la région 1 et 2, une petite partie, non traduite est un promoteur qui ne va fonctionner qu’en DL (très tardif).
IE1 va donner une protéine de 68 et 72kD, IE2 donnent un 86, 55 et 40kD. Les protéines ont des rôles de transrégulation pour le gène du CMV (transactivation surtout) transactivation directe ou indirecte par des TBP.
Chaque partie d’une protéine (l’exon) peut avoir un rôle (transactivation, active un promoteur…). On a certaines protéines qui vont agir en synergie pour la production d’autres protéines. Une protéine synthétisée va activer une autre protéine qui, elle, va activer l’autre protéine (typique de tous les promoteurs forts). On a possibilité d’activer d’autres virus que l’herpès (lentivirus …).
Il y a une mise en route supplémentaire par rapport par rapport à la réplication virale. On aura un transcrit primaire qui va être réarrangé, une protéine sous clivée et un déplacement du cadre de lecture.
Ces protéines (précoces tardives et tardives précoces) vont avoir fonction d’atténuation (ralentissement) pour la mise en route de la réplication.
3.2. Réplication du DNA
Il entraîne une réorganisation totale du noyau cellulaire. On aura une condensation de l’appareil nucléaire avec formation d’un réseau dense de protéines nécessaires à la synthèse viral et formation de capsides. On a, au moment de la réplication virale, association de plusieurs brins (séquences cohésives) qui se dissocient à l’encapsidation. Il suffit de 11 régions pour permettre la réplication UL54 donne le gène pol (ADN pol d’environ 140kD) monomérique (très grande spécificité). L’avantage est qu’elle est très spécifique mais elle a pour inconvénient de laisser intacte la cellule si l’on bloque cette pol.
Il y a mise en place d’un complexe avec beaucoup de protéines (hélicases…) et 3 protéines régulatrices.
On peut aussi avoir fabrication de concatémères organisés sur la région b’a’a’c’, des protéines spécialisées coupent les séquences (régions « a » aux extrémités). Il peut y avoir des incidents de coupures. Certains virus auront des séquences répétées, d’autres seront défectifs. Pour éviter de couper au mauvais endroit, le génome multiplie le nombre de a.
3.3. Assemblage du CMV
Une protéine essentielle de 44 kD codée par UL80CT. D’autres interviennent et vont dériver de précurseurs. On dénombre 8 protéines intervenant parmi laquelle une est importante, la gp130 (et gp55, protéine de sous clivage). La gp130 permet la pénétration du virus dans la cellule mais permettent la fusion de cellules entre elles (important pour la formation d’hybridomes). La nucléocapside, formée dans le noyau, va quitter celui-ci en récupérant une enveloppe de la membrane nucléaire. Cette nucléocapside traverse le cytoplasme, la membrane est plus ou moins détruite, le virus récupère des matières amorphes. Au niveau des endosomes, il acquiert sa membrane définitive. Il va suivre les canaux d’ergastoplasmes. On a libération des particules virales sous formes de corps denses (particules non infectieuses, gouttes de protéines virales enveloppées de la même membrane, ce qui sature le système immunitaire).
3.4. Relation CMV-Cellule
Les cellules infectées par le CMV ont un métabolisme très
actif. Le CMV, par ses protéines de régulation, stimule indirectement la cellule.
L’attachement du CMV sur la membrane cellulaire se fait à des récepteurs dont
certains correspondent au site de croissance.
Le CMV active 2 vagues de synthèses cellulaires : avant et après sa propre
synthèse.
La 1ère vague se fait de façon aléatoire par rapport au système des histones. Il va y avoir stimulation des RNA pol I, II et III. La II est stimulée de 16 à 18 fois. Au moment de l’infection, on a diminution des synthèses cellulaires et augmentation ensuite.
3.5. Notion de latence au niveau cellulaire
Elle fait suite à une primo infection, on a pas de modèle animal (on a quand même un CMV murin). La seule chose mise en évidence à été la forme du DNA. Il n’était pas intégré mais sous forme de structure nucléosomique et semblable à celles des structures cellulaires (comme les papovavirus). La 1ère vague de stimulation est indépendante de la synthèse des histones. Les histones sont utilisés par les virus et les cellules.
La structure nucléosomique pourrait faire penser qu’il y a une régulation par des protéines cellulaires ce qui est vrai puisque on a régulation par NFКB. Pendant cette phase, presque tous les IE vont s’exprimer dont un va réguler le système pour maintenir la latence.
3.6. Transformation
Le CMV a été impliqué dans certains symptômes (cancers du colon, syndrome de Kaposi). Le CMV induit-il le cancer ?
Le CMV rentre, induit le cancer et disparaît (« hit and run »). On a localisé 2 régions principalement actives dans l’oncogenèse du CMV. Ce sont des séquences très conservées à travers les différents herpes. Trois constantes sont bizarres :
- Des petits fragments d’ADN qui ne sont pas capables de coder pour une protéine transformante peuvent transformer les cellules in vitro.
- L’ADN utilisé pour transformer la cellule disparaît (même après marquage).
- Aucune des protéines éventuellement transformante n’a été trouvée.
La structure de l’ADN pourrait avoir une structure en tige-boucle, ce qui activerait l’expression d’un oncogène cellulaire ou faire l’effet d’un mutagène. Dans cette séquence conservée (entre espèces d’herpes), on a un motif d’environ 6-8 bases qui correspond environ à la séquence SP1 (enhancer d’un oncogène).
L’infection par CMV provoque des réarrangements (cassures et réparation). L’altération des gènes cellulaires (leur expression) : la cellule va être activée, sa réplication de l’ADN cellulaire donc emballement, cassure, aberration vont mener au dérèglement de l’expression des gènes.
Le virus peut coder pour des enzymes qui sont importantes dans le contrôle de la régulation cellulaire (kinase). Elles vont réguler les enzymes impliquées dans la croissance cellulaire (dés 1h30 après infection, une kinase virale était présente). Le virus met en route le système de transformation.
● Les HSV
Ce sont les HHV1 et HHV2, anciennement appelés Herpes Simplex Virus. Ce sont des virus neurotropiques ayant servi à cibler les cellules nerveuses en thérapie.
Ils peuvent même provoquer des phases lytiques, ou persister sous forme d’épisomes (non intégré dans le noyau pendant la phase de latence. Si le génome était intégré, il se multiplierai en même temps que la cellule or ce n’est pas le cas ici. On peut par contre évoluer, s’il s’intègre, vers une cancérisation (cas d’une multiplication synchrone par rapport à la cellule. Si le génome se multiplie au maximum, il va vers un cycle lytique. Pendant la phase de latence, il persiste. Pour cela, il possède des gènes qui peuvent être régulés par des promoteurs cellulaires (types neurones). La cellule produit des régulateurs qui empêchent le virus de s’exprimer.
Dans les régions bac (IRL-IRS), on a des LAT (Late Associated Transcript) grâce auxquels on a une coordination entre l’expression du virus et la cellule. Par ces LAT, on a établissement et réaction du virus.
Le cycle lytique a lieu en une dizaine d’heures (in vitro).
Les signes cliniques sont : éruptions cutanées type herpes au niveau de parties innervées.
Il doit y avoir des promoteurs intéressants sensibles aux protéines cellulaires. Ceux-ci sont utilisés dans des expressions de transgenèse (comme d’autres promoteurs). Beaucoup de vecteurs à base de HSV ont été synthétisés en délétant les gènes.
L’infection peut avoir lieu à différents niveaux :
Mononucléose à Herpes donne une hépatite modérée, splénomégalite, lymphadénopathie.
Infection congénitales (avec passage de la barrière placentaire), sarcome de Kaposi.
Infection au niveau muqueuses (buccale, anale…)
Inflammation du système central.
La prévention du virus se fait par des acyclovir (AZT..). L’éradication totale est impossible. Il peut y avoir des pauses (souvent lié à un phénomène hormonal), réactivés par des stress. Les infections chez les jeunes enfants peuvent commencer dés 1 an. La 1ère infection est asymptomatique, viennent ensuite les cycles éruption-pause….
Il n’existe pas de vaccin contre l’Herpès mais beaucoup sont à l’étude. Les recherches actuelles sur la maladie d’Alzheimer pourraient être couplées aux Herpesvirus.
● Le VZV (Varicella Zoster Virus).
Répandu chez les hommes et les animaux, il fait environ 125 Kb. Il est appelé VZV ou chicken pox (chair de poule). C’est une maladie qui passe par voie respiratoire ou conjonctive. La primo-infection se fait par système sanguin ou endothélial.
Le signe clinique est une vésicule pleine de liquide transparent contenant des virus.
Dans des cas exceptionnels, il peut y avoir atteinte du SNC, auquel cas, c’est grave.
Zona (chez pers. Agées)
Après infection, on a un réservoir de virus au niveau ganglions sensitifs, causant des zonas et des phlébites.
Traité par des acyclovirs, ces maladies peuvent toucher des nerfs crâniens (désordre psychologique ou physique jusqu’à cécité complète dans certains cas).
La transmission a lieu, comme pour le HSV, par contact direct.
● Le CMV
C’est un des plus grands (250 Kb). L’infection in vivo a lieu en 7-14 jours (contre 24-48h pour le HSV).
Il est à noter que le génome du CMV a de grandes homologies avec l’ADN cellulaire, ce qui en fait un virus difficile à combattre car possède des promoteurs cellulaires.
La transmission se fait par voie orale, les infections sont asymptomatiques. Les principales cibles sont les femmes enceintes, les nouveaux nés, les personnes immunodéprimées.
● L’EBV (Epstein-Barr Virus)
Celui-ci a un double tropisme : Lymphocytes B et cellules épithéliales. Sur lymphocytes B, l’infection est non productive alors que sur cellules épithéliales, on a une forte production.
Ils sont très répandus dans le monde, souvent sous forme latente. Il ressort souvent quand on a une 2ème infection par l’EBV ou une autre espèce.
Présent chez de nombreuses personnes, il va s’exprimer de façon violente et peut donner le lymphome de Burkitt (leucémie des lymphocytes B) ou des carcinomes au niveau nasopharynx.
Il n’existe pas de thérapie ni de vaccin.
Chez les jeunes enfants (2-3 ans), dans les cas d’un dérèglement génétique, il y a surréaction du système immunitaire dû au XLP (X Linked Proliferative immune response)(= lymphoproliferative). Soit on a une fièvre rapide, mort très rapide, soit cancer des ganglions lymphatiques.
Un marqueur est possible pour suivre la présence ou pas du virus, c’est une protéine « SLAM ». Elle met en évidence l’activation des lymphocytes (Signalling Lymphocyte Activation Molécule). Si la quantité de SLAM est élevée, on a hyperactivation des lymphocytes B dû à un virus de type EBV (ou autre cause).
Une autre molécule qui est sécrétée par la cellule : la SAP (SLAM Associated Protein). Dans le cas normal, SLAM et SAP marchent ensembles.
● Le HHV VI
Isolé en 1986 dans les lymphocytes du patient. Tropisme pour les cellules CD4. On a cru à un Lentivirus. Lé génome mesure 160 Kb (trop grand pour être un lentivirus). Largement répandu dans le monde, il est responsable de la roséole (maladie infantile). C’est une maladie sans gravité avec un fort taux au départ et diminution ensuite. Le taux d’Ac diminuera avec l’age.
Si une enfant n’a pas eu la roséole mais l’attrape quand il est grand, ça peut être plus grave (hépatites évoluant vers un cancer du foie). Cela touche en premier les immunodéprimés.
Le traitement se fait par des acyclovirs.
● Le HHV VII
Découvert en 1990, il possède un tropisme pour les lymphocytes T4 . Il possède une très grande conservation du génome du VI (une forme évoluée ?). Très faibles réactions croisées sur le plan antigénique. Il est souvent associé au VI (transactivation ?).
● Le HHV VIII
C’est un Herpes qui date de 98-99 trouvé associé au SIDA et au syndrome de Kaposi. (85% associé au Kaposi et 15% chez les SIDA non Kaposi). Ce virus est peu connu, il semble moins répandu que les autres (vient d’être découvert).Des études récentes sont menées par PCR sur le HHV VIII.
LA propagation serait plus importante que prévu (grâce à la PCR). On en a trouvé au niveau de la semence (sperme) mettant en évidence une transmission par voie sexuelle et sanguine.
Dans le génome du VIII, un grand nombre de gènes cellulaires piratés sont présents. Ils forment un bouquet oncogénique (oncogenic cluster).
____________________________